Nat Immunol:营养驱动免疫:GLP-2通过成纤维细胞重塑TSLP–ILC2–tuft回路
来源:BioArt 2025-12-02 16:14
本研究发现小肠在进食后会迅速启动一条跨越内分泌、基质、免疫与上皮的信号通路。
小肠黏膜既要吸收营养,又要抵御饮食来源的潜在危害,因此必须在上皮、基质、免疫与内分泌之间建立高度协调的局部网络。多类先天淋巴细胞(包括ILC1/2/3、IEL、γδ T、RORγt⁺ APC与Tregs)与上皮和菌群共同调节营养吸收、免疫耐受、代谢以及黏膜保护,使小肠能在禁食、进食及昼夜节律变化中维持稳态【1, 2】。然而,作为固有层最常见的组织驻留淋巴细胞之一,ILC2在无感染状态下长期存在,其真正的稳态功能始终缺乏明确解释。
之前研究发现,tuft细胞(簇细胞)释放的IL-25可激活ILC2,使其分泌IL-13并推动上皮向分泌谱系偏移,形成蠕虫感染中典型的 “weep and sweep” 回路【3】。IL-25信号若失控(如缺乏负调控因子A20),则即便没有感染也会诱导异常的II型免疫,提示稳态下必然具有更严格的阈值调控。由于IL-25、IL-33与TSLP均可激活ILC2,小肠中极有可能存在一个由多源警报素设定的 “基础活化程序”,并与进食等周期性生理刺激相耦合【4】。
近日,加州大学旧金山分校Richard M. Locksley实验室等在Nature Immunology杂志发表了题为TSLP links intestinal nutrient sensing with amplification of the ILC2–tuft cell circuit的研究文章,揭示了一条从进食到上皮重塑的连续信号通路,发现进食触发内分泌细胞释放GLP-2,GLP-2激活亚上皮成纤维细胞产生TSLP,TSLP驱动ILC2分泌IL-13,而IL-13通过上皮IL-4Rα信号推动tuft细胞扩增。由此形成的GLP-2–TSLP–ILC2–tuft回路,使小肠能够根据营养摄入情况动态调整上皮化学感受与屏障功能,为ILC2在稳态小肠中的存在提供了新的生物学解释。

Flare-TSLP 报告小鼠显示,TSLP在稳态下主要由PDGFRα⁺PDPN⁺成纤维细胞表达,这些细胞沿绒毛–隐窝轴连续分布,并呈绒毛端细胞与隐窝滋养细胞的经典空间模式。造血细胞和上皮细胞(包括 tuft 细胞)不表达 TSLP。流式分选与转录分析进一步确认这些亚上皮成纤维细胞携带维持干细胞、建立WNT/BMP梯度的标志性基因组合,在上皮维护中发挥了核心作用。因此,静息小鼠小肠TSLP主要来源于绒毛端细胞、滋养细胞及LECs等亚上皮成纤维细胞。
接下来作者发现小鼠16小时禁食后重新灌胃营养浆,TSLP⁺基质细胞与组织TSLP水平均迅速上升,并在2小时左右达到峰值;这一过程不依赖tuft细胞。进食4小时后,ILC2中IL-13报告信号增强,而在TSLPR缺失(全身或ILC2特异性)小鼠中,该反应大幅减弱。成纤维细胞特异性敲除TSLP同样削弱ILC2活化,而敲除淋巴内皮细胞TSLP则影响不大,表明进食相关的关键 TSLP来源为亚上皮成纤维细胞。
单细胞RNA测序显示,TSLP⁺成纤维细胞高度富集Glp2r,而肠上皮和免疫细胞中表达极低。GLP-2激动剂给药可提升TSLP⁺成纤维细胞比例与TSLP蛋白,体外亦能诱导成纤维细胞与组织外植体分泌TSLP。mTOR、ERK、cAMP–CREB轴的抑制可阻断这一效应。相应地,Glp2r⁻/⁻小鼠无法在进食后上调TSLP,也缺乏ILC2激活,进一步证明GLP-2为营养信号与 ILC2回路之间的关键中枢。
在上皮层面,GLP-2 给药可显著增加 DCLK1⁺ tuft 细胞数量,并依赖TSLPR、IL-13Rα1与上皮 IL-4Rα。成纤维细胞特异性敲除TSLP同样削弱GLP-2诱导的tuft细胞扩增。利用CCK谱系驱动的DREADD激活肠内分泌细胞GPCR通路,也可在无进食刺激下提升ILC2活性并扩增 tuft细胞,进一步确认GLP-2–TSLP–ILC2–上皮IL-4Rα轴构成了进食依赖簇细胞放大回路的关键信号。
此外,在寄生虫感染(如 T. muris)中,TSLP与GLP-2–TSLP轴同样部分参与ILC2激活,与寄生虫利用IL-25直接刺激tuft细胞的经典路线相互交织。由于寄生虫代谢物可绕过营养依赖的上游环节直接激活tuft细胞,它们能够在宿主小肠构建一个持续偏向II型免疫、利于自身生存的局部环境。
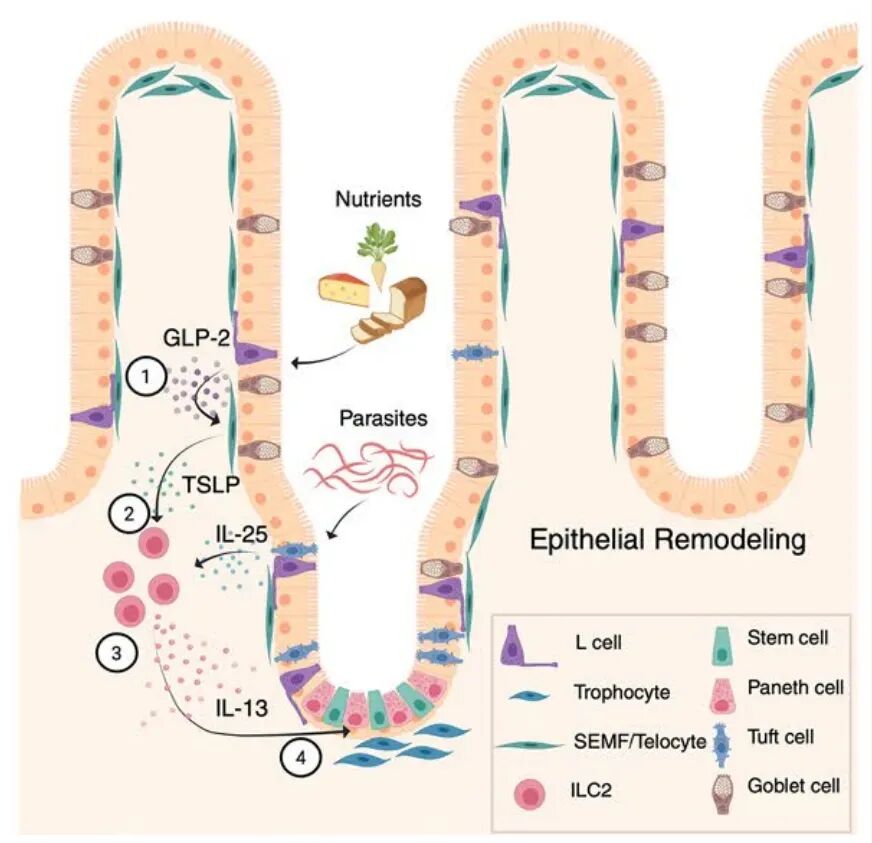
综上所述,本研究发现小肠在进食后会迅速启动一条跨越内分泌、基质、免疫与上皮的信号通路:肠内分泌细胞释放GLP-2,激活绒毛端细胞与隐窝滋养细胞上调 TSLP;TSLP随后驱动ILC2产生IL-13,使上皮向分泌谱系偏移并扩增tuft细胞,从而增强对饮食成分和寄生虫胁迫的化学感知能力。该GLP-2–TSLP–ILC2–tuft回路揭示了ILC2在稳态小肠中的核心调节作用,并解释了营养感知如何被转译为上皮监视与局部免疫调控信号。
原文链接:
https://doi.org/10.1038/s41590-025-02328-y
参考文献
1. Godinho-Silva, C. et al. Light-entrained and brain-tuned circadian circuits regulate ILC3s and gut homeostasis. Nature 574, 254–258 (2019).
2. Sullivan, Z. A. et al. γδ T cells regulate the intestinal response to nutrient sensing. Science 371, eaba8310 (2021).
3. von Moltke, J., Ji, M., Liang, H.-E. & Locksley, R. M. Tuft-cell-derived IL-25 regulates an intestinal ILC2-epithelial response circuit. Nature 529, 221–225 (2016).
4. Schneider, C. et al. A metabolite-triggered tuft cell-ILC2 circuit drives small intestinal remodeling. Cell 174, 271–284 (2018).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


